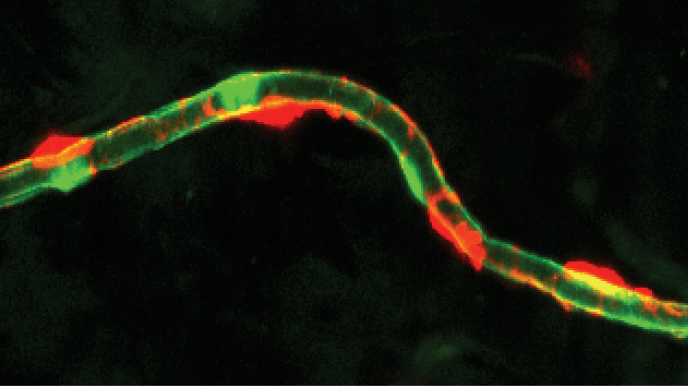
全身を張り巡らす血管は、からだのすべての細胞に酸素や栄養を供給し、二酸化炭素や老廃物を回収するいわば“生命維持に必須のライフライン”です。しかし、最近の研究から、血管は単に血液を運搬する管ではなく、より多様な機能を有することが明らかになりつつあります。例えば、血管内皮細胞は、臓器ごとに特有の機能遺伝子を発現し、各臓器の機能を担っています。また、血管内皮細胞はアンジオクラインファクターと呼ばれる生理活性物質を産生することで、臓器の形成や維持、組織修復、幹細胞の維持など多様な機能を制御することが分かってきました。このため血管機能の異常は、日本人の主要な死因を含む様々な疾患の発症や進展と密接に関連しています。また、人は加齢とともに老化しますが、その根本的な原因のひとつも血管機能の破綻にあると考えられています。したがって、人が健康で長生きできる社会の実現には、血管に関する理解を深めることがとても重要です。
私たちの研究室では、“血管が如何に形作られ機能しているのか?”、“血管機能の破綻が如何に様々な病気の発症や進展、加齢に伴う個体老化を引き起こすのか?”といった疑問を分子・細胞・臓器・個体レベルで解明することを目的に研究を進めています。

分子細胞構造学 私設HP
研究テーマ
ゼブラフィッシュを用いた蛍光イメージングによる血管研究
ゼブラフィッシュをモデル動物として用いたin vivo蛍光イメージングで、生体内の血管新生や血管構造の動態をリアルタイムに観察・解析しています。特に、内皮細胞やペリサイトの振る舞いに注目し、血管形成や機能維持の仕組みを解明しています。
血管新生の制御機構に関する研究
血管新生は、既存の血管から新たな血管が形成される現象で、発生期や創傷治癒において重要な役割を果たします。一方、がんや加齢黄斑変性症などでは、異常な血管新生が病態の悪化に関与します。私たちは、生理的血管新生と病的血管新生の制御機構の違いを明らかにすることで、疾患の理解と新たな治療法の開発につなげることを目指しています。
ペリサイトによる血管機能制御に関する研究
毛細血管では、ペリサイトが血管内皮細胞を覆い、血管の安定性や透過性、血流、さらには血管新生を制御していると考えられていますが、その詳細は未解明です。私たちはゼブラフィッシュを用いて、ペリサイトの機能や寿命・維持機構、血管新生における役割をライブイメージングで解析し、血管機能を支える仕組みの解明を目指しています。
血管透過性とバリア機能の調節機構に関する研究
血管内皮細胞は互いに接着することで、血液成分の漏出を防ぐバリアを形成しています。私たちは、このバリア機能の維持に重要な低分子量Gタンパク質Rap1シグナルに着目し、肺水腫や急性呼吸窮迫症候群など、血管透過性の亢進が関与する疾患の発症機構や加齢の影響について研究しています。特に、高齢者においてバリア機能が破綻しやすくなる仕組みを解明し、重症化リスクの低減を目指しています。
加齢による血管機能の変容と個体老化に関する研究
血管は単なる輸送路ではなく、臓器ごとに特有の機能を持ち、私たちの体の恒常性を支えています。しかし、血管内皮細胞が担うこれらの臓器特異的機能が、加齢によりどのように変化し、個体の老化にどう影響するかは十分に解明されていません。私たちは、加齢により内皮細胞がその機能を失うことが全身の老化を促進するという仮説のもと、シングルセル解析や老化モデルマウスを用いて、血管由来の老化制御機構の解明に取り組んでいます。
肺胞の形態形成メカニズムとその再生医療への応用に向けた研究
肺は呼吸を担う臓器であり、ガス交換が行われる場が肺胞です。私たちは、肺胞構造を形づくる血管内皮細胞がどのように発生・分化し、血管ネットワークを構築するのかを研究しています。こうした知見をもとに、肺胞再生を目指した再生医療の実現に貢献することを目指しています。
業績
2016年以降の論文を掲載。学術誌に報告した論文リストは下記でご覧いただけます。
https://scholar.google.de/citations?user=w1NElGcAAAAJ&hl=en2025
-
Ishii T. Yuge S. Ando K. Zhou W. Fukuhara S.* Pericyte-mediated regulation of angiogenesis during cutaneous wound healing in adult zebrafish. Communications Biol. 8, 1101 (2025).
https://doi.org/10.1038/s42003-025-08517-7 - Hanada Y., Halder S., Arima Y., Haruta H., Ogo H., Ogura S., Shiraki Y., Nakano S., Ozeki Y., Fukuhara S., Uemura A., Murohara T., Nishiyama K. Biomechanical control of vascular morphogenesis by the surrounding stiffness. Nat. Commun. 16, 6788 (2025). https://doi.org/10.1038/s41467-025-61804-z
- Nguyen L., Dohi T.*, Watanabe-Takano H.*, Fukuhara S*., Ogawa R. Comprehensive analysis of keloid vasculature by tissue clearing and 3D imaging. Wound Repair Regen. 2025 Mar-Apr;33(2):e70015. doi: 10.1111/wrr.70015.
2024
- Nishima S., Kashiwada T.*, Saito Y., Yuge S., Ishii T., Matsuda K., Kamio K., Seike S., Fukuhara S*., Gemma A. Bortezomib induces Rho-dependent hyperpermeability of endothelial cells synergistically with inflammatory mediators. BMC Pulmonary Medicine 2024 Dec 18;24(1):617. doi: 10.1186/s12890-024-03387-x.
- Otomo K., Omura T., Nozawa Y., Edwards S., Sato Y., Saito Y., Yagishita S., Uchida H., Watakabe Y., Naitou K., Yanai R., Sahara N., Takagi S., Iwata Y., Hayakawa Y., Otsuka K., Watanabe-Takano H., Haneda Y., Fukuhara S., Nii T., Takeshita N., Saba R., Yashiro K., Kaku M., Yamada T., Koike H., Oishi Y., Sekine K., Koga J., Kimura K., Karibe F., Kin E., Manabe I., Nemoto T., Tainaka K., Hamada A., Brismar H., A. Susaki E.A. descSPIM: an affordable and easy-to-build light-sheet microscope optimized for tissue clearing techniques. Nat. Commun. 2024 Jun 12;15(1):4941. doi: 10.1038/s41467-024-49131-1.
- Watanabe-Takano H.*, Kato K., Oguri-Nakamura E., Ishii T., Kobayashi K., Murata T., Tsujikawa K., Miyata T., Kubota Y., Hanada Y., Nishiyama K., Watabe T., Fässler R., Ishii H., Mochizuki N., Fukuhara S.* Endothelial cells regulate alveolar morphogenesis by constructing basement membranes acting as a scaffold for myofibroblasts. Nat. Commun. 2024 Mar 4;15(1):1622. doi: 10.1038/s41467-024-45910-y.
2023
- Yamamoto K., Watanabe-Takano H., Oguri-Nakamura E., Matsuno H., Horikami D., Ishii T. Ohashi R., Kubota Y., Nishiyama K., Murata T., Mochizuki N., Fukuhara S.* Rap1 small GTPase is essential for maintaining pulmonary endothelial barrier function in mice. FASEB J. 2023 Dec;37(12):e23310. doi: 10.1096/fj.202300830RR.
- Yuge S., Ishii T., Noishiki C., Fukuhara S.* Novel regulatory mechanisms underlying angiogenesis during wound healing revealed by fluorescence-based live-imaging in zebrafish. J. Biochem. 2023 Mar 17;mvad024. doi: 10.1093/jb/mvad024.
- Mizukami K., Higashiyama H., Arima Y., Ando K., Okada N., Kose K., Yamada S., Takeuchi J.K., Koshiba-Takeuchi K., Fukuhara S., Miyagawa-Tomita S., Kurihara H. Coronary artery established through amniote evolution. eLife 2023; 12:e83005. https://doi.org/10.7554/eLife.83005
2022
- Yuge S, Nishiyama K., Arima Y., Hanada Y., Oguri-Nakamura E., Hanada S., Ishii T., Wakayama Y., Hasegawa U., Tsujita K., Yokokawa R., Miura T., Itoh T., Tsujita K., Mochizuki N., Fukuhara S.* Mechanical loading of intraluminal pressure mediates wound angiogenesis by regulating the TOCA family of F-BAR proteins. Nat. Commun. 2022 May 12;13(1):2594. doi: 10.1038/s41467-022-30197-8.
- Ando K., Tong L., Peng D., Vázquez-Liébanas E., Chiyoda H., He L., Liu J., Mochizuki N., Fukuhara S., Grutzendler J., Betsholtz C. KCNJ8/ABCC9-containing K-ATP channel modulates brain vascular smooth muscle development and neurovascular coupling. Dev. Cell In press.
- Nishimura Y.**, Ishii T.**, Ando K., Yuge S., Nakajima H., Zhou W., Mochizuki N., Fukuhara S.* Blood flow regulates glomerular capillary formation in zebrafish pronephros. Kidney360 April 2022, 3 (4) 700-713; DOI: https://doi.org/10.34067/KID.0005962021 **Equal contribution.
- Sasaki Y., Higashijima Y., Suehiro J., Sugasawa T., Oguri-Nakamura E., Fukuhara S., Nagai N., Hirakawa Y., Wada Y., Nangaku M., Kanki Y. Lysine demethylase 2B regulates angiogenesis via Jumonji C dependent suppression of angiogenic transcription factors. Biochem Biophys Res Commun. 2022 May 21;605:16-23. doi: 10.1016/j.bbrc.2022.03.054.
- Peng D., Ando K., Hußmann M., Gloger M., Skoczylas R., Mochizuki N., Betsholtz C., Fukuhara S., Schulte-Merker S., Lawson ND., Koltowska K. Proper migration of lymphatic endothelial cells requires survival and guidance cues from arterial mural cells. eLife 2022 Mar 22;11:e74094. doi: 10.7554/eLife.74094.
- Watanabe-Takano H., Fukumoto M., Fukuhara S., Mochizuki N. Protocol for whole-mount X-gal staining combined with tissue clearing in embryo and adult mouse using CUBIC. STAR Protoc. 3: 101127, March 18, 2022.
2021
- Yamamoto K., Takagi Y., Ando K., Fukuhara S.* Rap1 small GTPase regulates vascular endothelial-cadherin-mediated endothelial cell-cell junctions and vascular permeability. Biol. Pharm. Bull. 2021;44(10): 1371-1379. doi: 10.1248/bpb.b21-00504.
- Okasato R., Kano K., Kise R., Inoue A., Fukuhara S., Aoki J. An ATX-LPA6-Gα13-ROCK axis shapes and maintains caudal vein plexus in Zebrafish. iScience 2021 Oct 12;24(11): 103254. doi: 10.1016/j.isci.2021.103254.
- Watanabe-Takano H., Ochi H., Chiba A., Matsuo A., Kanai Y., Fukuhara S., Ito N., Sako K., Miyazaki T., Tainaka K., Harada I., Sato S., Sawada Y., Minamino N., Takeda S., Ueda H.R., Yasoda A., Mochizuki N. Mechanical load regulates bone growth via periosteal Osteocrin. Cell Reports 2021 Jul 13;36(2):109380. doi: 10.1016/j.celrep.2021.109380.
- Ando K., Ishii T., Fukuhara S., Zebrafish vascular mural cell biology: recent advances, development, and functions. Life (Basel) 2021 Oct 3;11(10): 1041. doi: 10.3390/life11101041.
- Ando K., Shih Y.-H., E. Lwaki, Grosse A, Portman D., Chiba A., Mattonet K., Gerri C., Stainier D.Y.R, Mochizuki N., Fukuhara S., Betsholtz C, Lawson N.D. Conserved and context-dependent roles for Pdgfrb signaling during zebrafish vascular mural cell development. Dev. Biol. 2021 Nov;479: 11-22. doi: 10.1016/j.ydbio.2021.06.010. Epub 2021 Jul 24.
- Rho S., Oguri-Nakamura E., Ando K., Yamamoto K., Takagi Y., Fukuhara S.* Protocol for analysis of integrin-mediated cell adhesion of lateral plate mesoderm cells isolated from zebrafish embryos. STAR Protoc. 2021 Mar 31;2(2):100428. doi:10.1016/j.xpro.2021.100428. eCollection 2021 Jun 18.
- Abdelhakim M., Dohi T., Yamato M., Takada H., Sakai A., Suzuki H., Ema M., Fukuhara S., Ogawa R. A new model for specific visualization of skin graft neoangiogenesis using Flt1-tdsRed BAC transgenic mice. Plast. Reconstr. Surg. 2021 Jul 1;148(1):89-99. doi: 10.1097/PRS.0000000000008039.
2020
- Kobayashi I., Kobayashi-Sun J., Hirakawa Y., Ouchi M., Yasuda K., Kamei H., Fukuhara S., Yamaguchi M. Dual role of Jam3b in early hematopoietic and vascular development. Development 2020 Jan 8;147(1). doi: 10.1242/dev.181040
- Fukushima Y., Nishiyama K., Kataoka H., Fruttiger M. Fukuhara S.,Nishida K., Mochizuki N., Kurihara H., Nishikawa S., Uemura A. RhoJ integrates attractive and repulsive cues in directional migration of endothelial cells. EMBO J. 2020 Apr 29:e102930. doi:10.15252/embj.2019102930.
2019
- Simmons S., Sasaki N., Umemoto E., Uchida Y., Fukuhara S., Kitazawa Y., Okudaira M., Inoue A., Tohya K., Aoi K., Aoki J., Mochizuki N., Matsuno K., Takeda K., Miyasaka M., Ishii M. eLife 2019 Oct 1;8. pii: e41239. doi: 10.7554/eLife.41239.
- Shin M., Nozaki N., Idrizi I., Isogai S., Ogasawara K., Ishida K., Yuge S., Roscoe B., Wolfe S.A., Fukuhara S., Mochizuki N, Deguchi T., Lawson N.D. Valves are a conserved feature of the zebrafish lymphatic system. Dev. Cell Published Online: September 26, 2019. doi: https://doi.org/10.1016/j.devcel.2019.08.019
- Rho S., Kobayashi I., Oguri-Nakamura E., Ando K., Fujiwara M., Kamimura N., Hirata H., Iida A., Iwai Y., Mochizuki N., Fukuhara S. (Corresponding author). Rap1b promotes Notch signal-mediated hematopoietic stem cell development by enhancing integrin-mediated cell adhesion. Dev. Cell 49(5): 681-696.e6 (2019). doi: 10.1016/j.devcel.2019.03.023
- *Noishiki C., *Yuge S., Ando K., Wakayama Y., Mochizuki N., Ogawa R., Fukuhara S. (Corresponding author). Live imaging of angiogenesis during cutaneous wound healing in adult zebrafish. Angiogenesis 22(2): 341-354 (2019) Jan 4. doi: 10.1007/s10456-018-09660-y. *Equal contribution.
- Ando K., Wang W., Peng D. Chiba A., Barske L., Crump J.G., Stainier D.Y.R., Lendahl U., Lagendijk A., Koltowska K., Hogan B.M., Fukuhara S., Mochizuki N., Betsholtz C. Peri-arterial specification of vascular mural cells from naïve mesenchyme requires Notch signaling. Development 2019 Jan 25;146(2). doi: 10.1242/dev.165589.
2017
- Rho S., Ando K., Fukuhara S. (Corresponding author). Dynamic regulation of vascular permeability by vascular endothelial cadherin-mediated endothelial cell-cell junctions. J. Nippon Med. Sch. 84 (4): 148-159 (2017).
- Takara K., Eino D., Ando K., Yasuda D., Naito H., Tsukada Y., Iba T., Wakabayashi T., Muramatsu F., Kidoya H., Fukuhara S., Mochizuki N., Ishii S., Kishima H., Takakura N. Lysophosphatidic acid receptor 4 activation augments drug delivery in tumors by tightening endothelial cell-cell contact. Cell Reports 20 (9): 2072-2086 (2017).
- Miura K., Nojiri T., Akitake Y., Ando K., Fukuhara S., Zenitani M., Kimura T., Hino J., Miyazato M., Hosoda H., Kangawa K. CCM2 and PAK4 act downstream of atrial natriuretic peptide signaling to promote cell spreading. Biochem. J. 474: 1897-1918 (2017).
- Nakajima H., Yamamoto K., Agarwala S., Terai K., Fukui H., Fukuhara S., Ando K., Miyazaki T., Yokota Y., Schmelzer E., Belting H.-G., Affolter M., Lecaudey V., Mochizuki N. Flow-dependent endothelial YAP regulation that contributes to vessel maintenance. Dev. Cell 40 (6): 523-536 (2017).
- Chiba A., Watanabe-Takano H., Terai K., Fukui H., Miyazaki T., Uemura M., Hashimoto H., Hibi M., Fukuhara S., Mochizuki N. Osteocrin, a peptide secreted from the heart and other tissues, contributes to cranial osteogenesis and chondrogenesis in zebrafish. Development 144:334-344 (2017).
2016
- Ando K., Fukuhara S. (Co-corresponding author), Izumi N., Nakajima H., Fukui H., Kelsh R.N., Mochizuki N. Clarification of mural cell coverage of vascular endothelial cells by live imaging of zebrafish. Development 143:1328-1339 (2016).
- Chávez-Vargas L., Adame-García S.R., Cervantes-Villagrana R.D., Castillo-Kauil A., Bruystens J.G.H., Fukuhara S., Taylor S.S., Mochizuki N., Reyes-Cruz G., Vázquez-Prado J. Protein kinase A (PKA) Type I interacts with P-Rex1, a Rac guanine nucleotide exchange factor: Effect on PKA localization and P-Rex1 signaling. J. Biol. Chem. 291: 6182-6199 (2016).
研究者一覧

-
高野 晴子
教授(ポストアップ)
t-haruko<at>nms.ac.jp
-
弓削 進弥
講師
-
石井 智裕
助教
-
上村 立記
日本学術振興会特別研究員PD
-
羽田 優花
博士研究員
-
松野 (鈴木) 仁美
博士研究員
-
早川 智久
博士研究員
-
水野 夏紀
大学院生
-
中村 エリ
テクニカルサポートスタッフ
-
荒井 邦仁
アシスタントサポートスタッフ
-
加藤 久充子
技術スタッフ・秘書
-
松下 由起子
技術スタッフ・秘書
-
橋本 雨音
技術スタッフ・秘書
-
友利 裕二
日本医科大学整形外科 講師